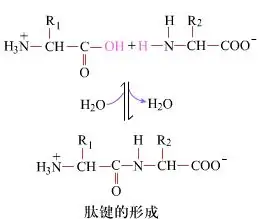
Pinnal on peptiidsidemete moodustumine, mis annab dipeptiide, lihtne keemiline protsess.See tähendab, et kaks aminohappekomponenti on dehüdreeritud olles seotud peptiidsidemega, amiidsidemega.
Peptiidsideme moodustumine on aminohappe aktiveerimine kergetes reaktsioonitingimustes.(A) karboksüülosa, teine aminohape (B) Seejärel moodustab nukleofiilne aktiveeritud karboksüülosa dipeptiidi (AB)."Kui karboksüülkomponent (A) ei ole kaitstud, ei saa peptiidsideme moodustumist kontrollida."Kõrvalsaadusi, nagu lineaarsed ja tsüklilised peptiidid, võib segada sihtühenditega AB.Seetõttu peavad kõik funktsionaalsed rühmad, mis ei osale peptiidsideme moodustumisel, olema peptiidi sünteesi ajal ajutiselt pöörduval viisil kaitstud.
Niisiis, peptiidide süntees - iga peptiidsideme moodustumine - hõlmab kolme agregatsioonietappi.
Esimese sammuna valmistatakse ette mõned kaitset vajavad aminohapped ja aminohapete tsvitterioonset struktuuri enam ei eksisteeri.
Teine etapp on kaheetapiline reaktsioon peptiidsidemete moodustamiseks, mille käigus N-kaitstud aminohappe karboksüülrühm aktiveeritakse esmalt aktiivseks vaheühendiks ja seejärel moodustub peptiidside.See seotud reaktsioon võib toimuda kas üheetapilise reaktsioonina või kahe järjestikuse reaktsioonina.
Kolmas samm on kaitsealuse valikuline või täielik eemaldamine.Kuigi kogu eemaldamine võib toimuda alles pärast kõigi peptiidahelate kokkupanemist, on peptiidide sünteesi jätkamiseks vajalik ka kaitserühmade selektiivne eemaldamine.
Kuna 10 aminohapet (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec ja Cys) sisaldavad kõrvalahela funktsionaalrühmi, mis vajavad selektiivset kaitset, muutes peptiidide sünteesi keerulisemaks.Eristada tuleb ajutisi ja poolpüsivaid kaitsealuseid, kuna selektiivsuse nõuded on erinevad.Ajutisi kaitserühmi kasutatakse järgmises etapis, et kajastada aminohappe või karboksüüli funktsionaalrühmade ajutist kaitset.Poolpüsivad kaitserühmad eemaldatakse juba moodustunud peptiidsidemeid või aminohapete kõrvalahelaid segamata, mõnikord sünteesi käigus.
"Ideaalis peaks karboksüülkomponendi aktiveerimine ja sellele järgnev peptiidsidemete moodustumine (sidestamisreaktsioonid) olema kiire, ilma ratseemilise või kõrvalsaaduste moodustumiseta ning kõrge saagise saavutamiseks tuleks kasutada molaarseid reagente."Kahjuks ei vasta ükski keemiline sidumismeetod neile nõuetele ja vähesed sobivad praktiliseks sünteesiks.
Peptiidide sünteesi käigus seotakse erinevates reaktsioonides osalevad funktsionaalrühmad tavaliselt manuaalse tsentriga, ainsaks erandiks on glütsiin ning seal on potentsiaalne rotatsioonioht.
Peptiidide sünteesitsükli viimane etapp on kõigi kaitserühmade eemaldamine.Kaitserühmade selektiivne eemaldamine on peptiidahela pikendamiseks oluline lisaks kaitse täieliku eemaldamise nõudele dipeptiidi sünteesis.Sünteetilised strateegiad tuleks hoolikalt planeerida.Sõltuvalt strateegilisest valikust võib N selektiivselt eemaldada α-amino- või karboksüülrühma kaitserühmad.Termin "strateegia" viitab üksikute aminohapete kondensatsioonireaktsioonide järjestusele.Üldiselt on järkjärgulise sünteesi ja fragmentide kondenseerumise vahel erinevus.Peptiidi süntees (tuntud ka kui "tavapärane süntees") toimub lahuses.Enamikul juhtudel saab peptiidahela järkjärgulist pikendamist sünteesida ainult peptiidahela abil lühemate fragmentide sünteesimiseks.Pikemate peptiidide sünteesimiseks tuleb sihtmolekulid segmenteerida sobivateks fragmentideks ja teha kindlaks, et need suudavad C-otsas diferentseerumise astet minimeerida.Pärast üksikute fragmentide järkjärgulist kokkupanemist ühendatakse sihtühend.Peptiidide sünteesi strateegia hõlmab parima ja sobivaima kaitsva fragmendi valimist ning peptiidide sünteesi strateegia hõlmab kõige sobivama kaitsvate aluste kombinatsiooni ja parima fragmentide konjugatsiooni meetodi valimist.
Postitusaeg: 19. juuli 2023